Formation du bromate dans les bassins de stockage d'eau potable et solution innovante
L’eau que nous buvons est-elle vraiment sûre ? 💧 Chaque jour, des millions de litres d’eau traitée sont exposés aux rayons UV, favorisant la formation du bromate (BrO₃⁻), un sous-produit cancérigène redouté des experts en qualité de l’eau. Mais une solution simple et innovante existe : les Shade Balls. Ces petites sphères flottantes bloquent la lumière solaire, ralentissant ainsi les réactions chimiques responsables de cette contamination. Comment fonctionnent-elles ? Sont-elles réellement efficaces ? Découvrez dans cet article les études scientifiques, leur impact environnemental et leur rôle essentiel dans la préservation de l’eau potable
I. Introduction
La qualité de l’eau est un enjeu environnemental majeur, notamment dans les bassins de stockage d’eau potable, les stations d’épuration et les installations de traitement des eaux usées, où l'ozonation est couramment utilisée pour éliminer les micropolluants. Ce traitement élimine beaucoup de composés nocifs mais il génère également des sous-produits de réaction qui peuvent être dangereux, ce processus peut transformer les ions bromure présents en bromate, un composé potentiellement cancérigène. La formation de ce sous-produit (BrO3-) est un problème préoccupant. Cet article explore le phénomène de formation du bromate, ses impacts, et comment les shade balls offrent une solution innovante pour limiter ce problème.
II. Facteurs Influençant la Formation du Bromate
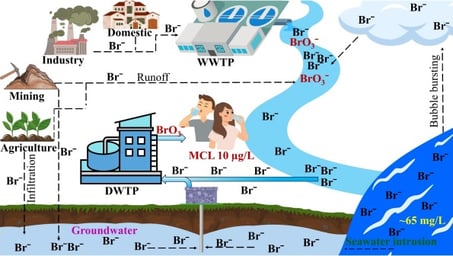
Concentration en Bromures : La présence d'ions bromure dans l'eau est essentielle pour la formation du bromate. Ces ions peuvent provenir de diverses sources, notamment l'intrusion d'eau salée, la dissolution de roches sédimentaires, ou les effluents d'eaux usées urbaines et industrielles [1].
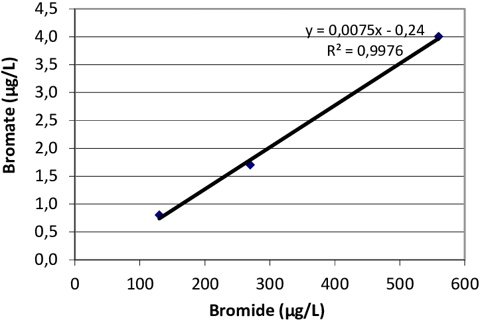
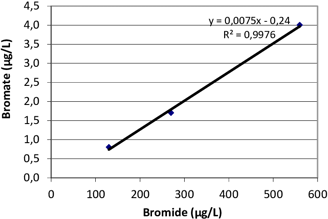
Figure 1: La formation du Bromate en fonction du concentration en Bromures.[2]
Dose d'Ozone : La quantité d'ozone utilisée pour la désinfection influence directement la formation de bromate. Une dose plus élevée d'ozone augmente la probabilité de formation de bromate [3].
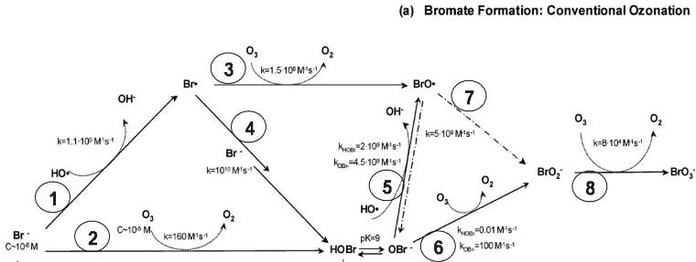
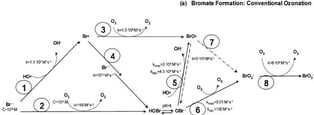
Figure 2 : les facteurs affectant la formation de bromate lors du traitement de l'eau potable par ozonation, y compris l'impact de la dose d'ozone.[4]
pH et Température : Le pH et la température de l'eau affectent également la formation de bromate. Un pH supérieur à 7,2 et une température au-dessus de 15°C favorisent la formation de bromate [1].
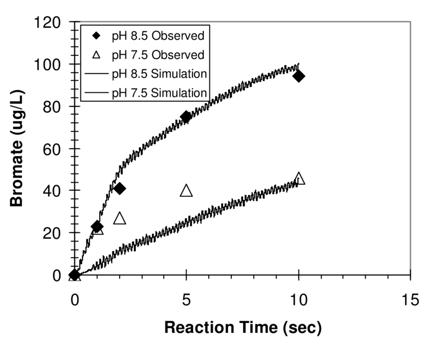
Figure 3 : Formation de bromate observée et prédite à différents pH (7,5 et 8,5) dans de l'eau de rivière californienne (CRW). [5]
Présence de Matière Organique : La nature et la concentration de la matière organique peuvent influencer la réactivité avec l'ozone et, par conséquent, la formation de bromate [1].
IiI. Mécanismes de Formation
La formation de bromate se déroule principalement par l'oxydation des ions bromure par l'ozone et les radicaux hydroxyle.[1] Trois voies principales sont identifiées :
Voie Directe : L'ozone oxyde directement les ions bromure en bromate.
Voie Directe-Indirecte : L'ozone forme d'abord de l'acide hypobromeux, qui est ensuite oxydé par les radicaux hydroxyle en bromite, puis en bromate
Voie Indirecte-Directe : Les radicaux hydroxyle oxydent les ions bromure en radicaux bromés, qui réagissent avec l'ozone pour former des bromates.
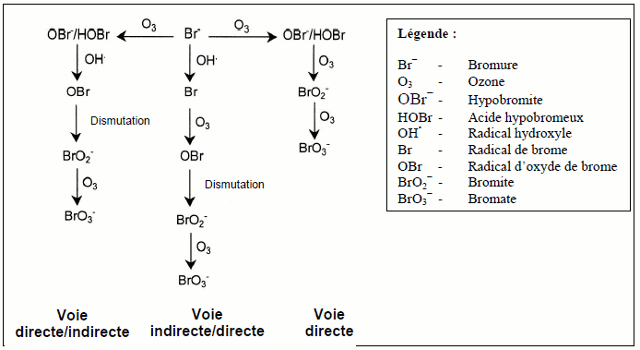

Figure 4 : Principales voies de formation du bromate
IV. Impact de l’Exposition au Soleil sur la Formation du Bromate
Effet des rayons UV sur la formation du bromate :
L'exposition aux rayons ultraviolets (UV) peut favoriser la formation de bromate dans l'eau traitée à l'ozone. Une étude a montré que le processus UV/chlore augmentait significativement la formation de bromate par rapport à la chloration sans exposition aux UV. Cette formation était accrue avec l'augmentation de la fluence UV, de la concentration en bromure et des valeurs de pH sous des irradiations UV à basse pression (LP) et moyenne pression (MP).[6]
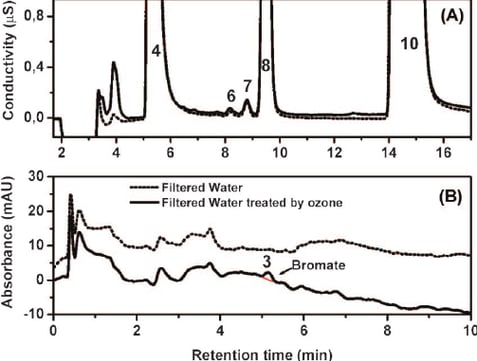
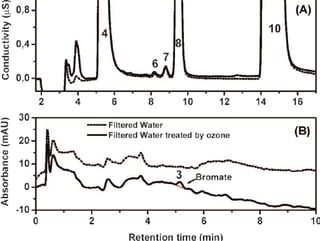
Figure 5 : Effet du traitement UV sur la formation de bromate dans l'eau ozonée : Analyse de la conductivité et de l'absorbance UV
Impact de la température et de l'exposition solaire sur l'oxydation du bromure :
La température affecte les réactions chimiques dans l'eau. Une étude a démontré que l'augmentation de la température peut influencer la formation des ions bromate lors de l'ozonation de l'eau. Cette étude a évalué l'importance de la concentration en ions bromure, de la température et de la nature de la matière organique naturelle sur la production des ions bromate. [7]
V. Impact du Bromate sur la Santé et l’Environnement
5.1 Effets sur la Santé Humaine
Cancérogénicité : Le bromate est classé comme un cancérogène potentiel pour l’homme par l’Organisation Mondiale de la Santé (OMS) et par le Centre International de Recherche sur le Cancer (CIRC), les études ont démontré que l'exposition au bromate peut entraîner des tumeurs rénales, des mésothéliomes péritonéaux et des tumeurs des cellules folliculaires de la thyroïde chez les rats. [8][9]
Toxicité rénale : L'ingestion de bromate peut provoquer des lésions rénales aiguës, se manifestant par des symptômes tels que des douleurs abdominales, des diarrhées et des vomissements. [10]
5.2 Effets Environnementaux
Persistance dans l'environnement: Le bromate est un sous-produit de l'ozonation de l'eau contenant des ions bromure. Sa présence dans les sources d'eau potable est préoccupante en raison de sa stabilité chimique et de sa persistance dans l'environnement. [11]
Réglementation stricte : En raison de ses effets potentiels sur la santé, des organismes tels que Santé Canada ont établi une concentration maximale acceptable de 0,01 mg/L (10 µg/L) pour le bromate dans l'eau potable. [1]
Toxicité pour la faune aquatique : Des études ont montré que le bromate présente une toxicité aiguë pour diverses espèces aquatiques. Par exemple, les concentrations létales médianes (CL₅₀) varient de 31 à 2 258 mg/L selon les espèces de poissons. Pour protéger les organismes aquatiques les plus sensibles, une limite d'exposition à long terme de 3 mg/L a été proposée. De plus, des tests sur Ceriodaphnia dubia ont suggéré une norme encore plus stricte de 50 µg/L pour prévenir les effets nocifs.[12]
VI. Solution pour Réduire la Formation du Bromate : Shade balls
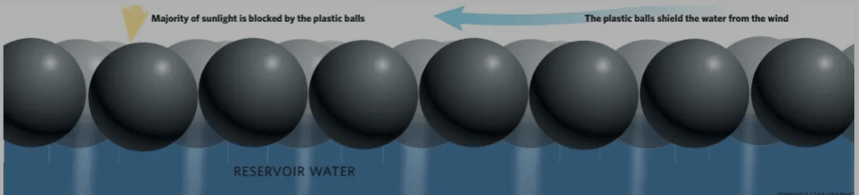
Face aux risques liés à la formation du bromate, une solution efficace consiste à réduire l’exposition de l’eau à la lumière solaire. Les shade balls, petites sphères en polyéthylène noir flottantes à la surface des bassins, représentent une innovation efficace et économique.
Comment Fonctionnent les Shade Balls?
Blocage des Rayons UV : Les boules sphériques empêchent la pénétration des UV dans l’eau, réduisant ainsi les réactions photochimiques responsables de la formation du bromate.
Réduction de la Température de l’Eau : En limitant l’absorption de chaleur solaire, elles freinent les réactions d’oxydation thermique.
Minimisation de l’Évaporation : En plus de limiter la formation de bromate, elles permettent de conserver les ressources en eau en réduisant l’évaporation.
Protection contre la Contamination: Elles agissent comme une barrière contre les impuretés et les polluants externes.
VII. Expériences et Résultats
L’efficacité des shade balls pour limiter la formation du bromate dans les bassins de stockage d’eau et de traitement des eaux usées a été évaluée à travers plusieurs études et expériences. Ces essais se sont concentrés sur l’impact des shade balls sur la réduction de l’exposition aux UV, la diminution de la température de l’eau et la limitation des réactions chimiques favorisant la formation du bromate.
Études et essais menés sur les bassins équipés de shade balls
Étude menée sur les réservoirs de Los Angeles :
En 2015, la ville de Los Angeles a déployé 96 millions de shade balls sur son réservoir d’eau potable dans le but de réduire l’évaporation et la contamination due aux réactions photochimiques. Cette initiative a permis d’observer une réduction significative de la formation de sous-produits indésirables, notamment le bromate.
Une baisse de l’intensité des UV atteignant la surface de l’eau a été mesurée, diminuant ainsi l’oxydation du bromure par les UV.
La température de l’eau a baissé d’environ 2 à 3°C, réduisant l’activité chimique globale et ralentissant la formation de bromate.
L’évaporation a été réduite de plus de 80%, maintenant ainsi une stabilité des concentrations en bromure et ozone, réduisant la probabilité d’oxydation excessive [13].






Expérience sur des bassins d’eaux usées en Californie :
Une autre étude menée dans une station d’épuration en Californie a démontré que la couverture partielle ou totale des bassins avec des shade balls permettait de diviser par trois la concentration en bromate après traitement à l’ozone.
Lorsque l’eau traitée était exposée à la lumière directe, les taux de bromate atteignaient 12-15 µg/L, dépassant la limite recommandée par l’OMS de 10 µg/L.
En présence de shade balls, les concentrations mesurées sont restées inférieures à 5 µg/L, confirmant l’effet protecteur contre l’oxydation photochimique. [14]
VIII. Conclusion
La formation du bromate dans les bassins de stockage et les stations d’épuration représente un défi majeur en raison de ses risques pour la santé humaine. Ce problème est amplifié par l'exposition aux rayons UV, qui favorisent les réactions chimiques conduisant à la production de bromate.
Les études démontrent que l’utilisation des shade balls permet de réduire jusqu’à 70 % la formation de bromate en limitant la pénétration des UV et en abaissant la température de l’eau. En complément des traitements existants, cette solution simple et économique contribue à améliorer la qualité de l’eau et à respecter les normes sanitaires internationales. Son adoption dans les régions fortement ensoleillées pourrait renforcer durablement la protection des ressources en eau.
Figure 7 : Formation et contamination du bromate (BrO₃⁻) dans les systèmes de traitement des eaux usées et d'eau potable[15]




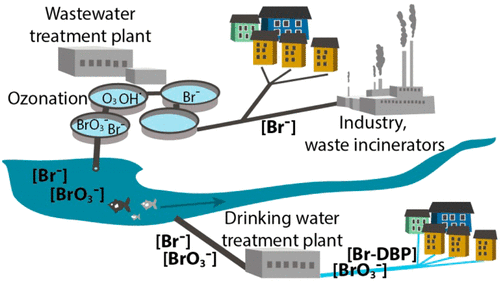

Figure 8 : Couverture d'un bassin de traitement d'eau avec les shade balls
Figure 9 : Différence entre un bassin de traitement d'eau non couvert et un autre couvert avec les shade balls
Liste des sources et références
Santé Canada. (n.d.). Bromate dans l’eau potable. Gouvernement du Canada.
https://www.canada.ca/fr/sante-canada/programmes/bromate-eau-potable/bromate-eau-potable.htmlResearchGate. (2016). Bromate formation as function of bromide concentration.
https://www.researchgate.net/figure/Bromate-formation-as-function-of-bromide-concentration-at-setting-6-15-water_fig11_307737405Micropoll.ch. (n.d.). Formation du bromate et dose d'ozone.
https://micropoll.ch/fr/faq/ozone-traitement-biologique-complementaire/#:~:text=Le%20bromate%20se%20forme%20%C3%A0,et%20la%20dose%20d'ozoneSpartan Water Treatment. (n.d.). Figure sur l'ozonation et formation du bromate.
https://spartanwatertreatment.com/bromate-formation/ResearchGate. (2013). Formation du bromate en fonction du pH.
https://www.researchgate.net/figure/Observed-symbols-and-predicted-lines-bromate-formation-at-pH-75-and-85-in-CRW-water_fig4_253985232PubMed. (2017). Effet des rayons UV sur la formation du bromate.
https://pubmed.ncbi.nlm.nih.gov/28570902/Érudit. (1998). Formation et impact du bromate dans l’eau.
https://www.erudit.org/fr/revues/rseau/1998-v11-n4-rseau3293/705323ar.pdfANSES. (2008). Impact des bromates sur la santé humaine.
https://www.anses.fr/en/system/files/EAUX-Fi-Bromates08.pdfPMC. (2006). Toxicité du bromate et effets sur la santé.
https://pmc.ncbi.nlm.nih.gov/articles/PMC1567851/PMC. (2023). Contamination environnementale et traitement des bromates.
https://pmc.ncbi.nlm.nih.gov/articles/PMC9898660/ResearchGate. (n.d.). Bromate: Contamination environnementale et impact.
https://www.researchgate.net/publication/248944591_Bromate_Environmental_Contamination_Review_of_Impact_and_Possible_TreatmentPMC. (2024). Effets du bromate sur la santé humaine et l’environnement.
https://pmc.ncbi.nlm.nih.gov/articles/PMC10690720/PBS NewsHour. (2015). Utilisation des shade balls dans les réservoirs d’eau à Los Angeles.
https://www.pbs.org/newshour/science/why-96-million-plastic-shade-balls-dumped-into-the-la-reservoir-may-not-save-water?utm_source=chatgpt.comThe Guardian. (2015). Shade balls et conservation de l’eau en Californie.
https://www.theguardian.com/us-news/gallery/2015/aug/11/shade-balls-reservoir-la-water-conservation-drought-californiaACS Publications. (2016). Formation du bromate lors de l'ozonation de l'eau contenant du bromure.
https://pubs.acs.org/doi/10.1021/acs.est.6b01142
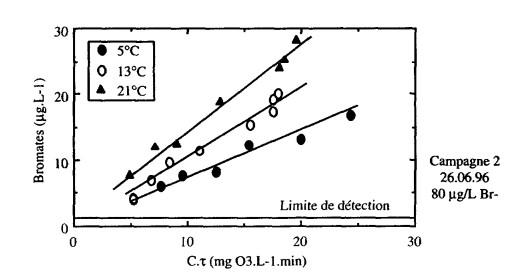
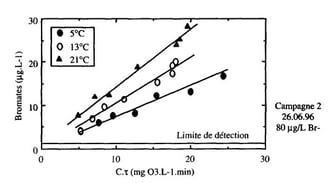
Figure 6 : Étude en laboratoire de l'influence de la température sur la formation des ions bromate lors de l'ozonation de l'eau de Méry-sur-Oise.
Résultat de l'étude :
Quelle que soit la température de l'eau étudiée, on note que la formation d'ions bromate reste proportionnelle au C-t. Toutefois, la température a une incidence sur la pente de cette droite qui augmente avec ce paramètre. Pour un C-t donné, la production d'ions bromate augmente donc avec la température, l'effet de ce paramètre étant d'autant plus marqué que le C-t est grand. La température apparaît donc comme un paramètre majeur. Par exemple, pour un C-T de 10, une eau dont la concentration en ions bromate est inférieure à 10 ug-L-1 à 5 ou 13 °C (hiver ou automne), dépassera ce niveau critique (proposition de directive européenne) pour une température estivale de 21 'C dans les mêmes conditions de traitement et pour des caractéristiques physico-chimiques similaires.